HISTORIA DE LA TABLA PERIÓDICA
Más allá de la mitad del siglo XVII, el químico y físico irlandés Robert Boyle creó el concepto moderno de elemento químico, para referirse a las sustancias elementales de su época, concepto que fue perfeccionado por el francés Antoine Lavoisier.
A comienzos de esta época Contemporánea, 1789, se hicieron los primeros intentos por representar, ordenar y clasificar los 55 elementos químicos hasta entonces conocidos, dado que esta cantidad de elementos ya era inmanejable, lo mismo que la información generada del estudio de los mismos y de que el descubrimiento de otros elementos se incrementaba. Estos intentos estuvieron encaminados a descubrir alguna relación existente entre las propiedades de tales elementos, resaltando el peso atómico en este aspecto.
Primeras representaciones de los Elementos Químicos
Se cree que los alquimistas fueron los primeros en tener y emplear un sistema de símbolos para representar a los elementos, compuestos y mezclas hasta entonces conocidos por ellos.
Luego John Dalton, y otros científicos de su época, tuvieron su propia manera de representar a los elementos químicos hasta entonces descubiertos. Él utilizo símbolos circulares para representar a cada elemento, y combinaciones de los mismos para representar a los compuestos.
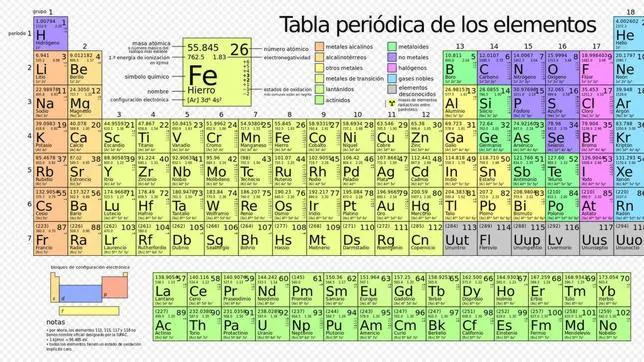
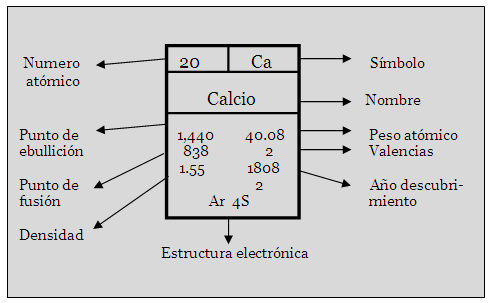
Así, muchas veces una información solo podía ser interpretada por quienes la generaban, lo cual creó la necesidad de tener un sistema aceptado de representación de los elementos. Éste paso fue dado por el químico sueco John Jacob Berzelius, en 1830, quien propuso su método: el símbolo de un elemento estaría representado por la primera letra de su nombre en latín, seguida de una segunda letra, en el caso de que la primera letra ya hubiese sido asignada a otro elemento. Este método o simbología de Berzelius es el que se utiliza en la actualidad.
Primeras tablas periódicas de los Elementos Químicos
Además de la necesidad de contar con un sistema de representación de los elementos químicos, también era imperioso en aquella época el ordenar y clasificar tales elementos, púes, se apuntó anteriormente, eran varios los elementos descubiertos, bastante la información existente sobre sus propiedades y, seguramente, se descubrirían otros.
Cerca de 200 años tomo el proceso de clasificar a los elementos químicos en una tabla periódica, periodo que va desde los primeros pasos que dio Lavoisier hasta la tabla que presento Mendeleiev; desde aquí, este proceso tomo 44 años más hasta que Mosley, en 1913, presentara la moderna tabla periódica de los elementos químicos.
El científico francés Antoine-Laurent Lavoisier (1743-1794) fue el primero en organizar los elementos en base a sus propiedades, formando los grupos siguientes: elementos no-metálicos formadores de ácidos, metálicos formadores de bases, formadores de sales, etc.
En 1815, el médico escocés W. Proust relaciono y organizo a los elementos por medio de la propiedad química llamada peso atómico. Para él, los pesos atómicos correspondían solo a números enteros(error), y el peso patrón fue el del Hidrogeno. Por estos años, Berzelius corrigió
todos los pesos de los elementos y demostró que a muchos de ellos no les correspondían números enteros, como el del Cloro (35.5), resultados que contribuirían mucho a futuros estudios.
Más tarde, John Dalton, profesor ingles de Química, también hizo cálculos sobre los pesos atómicos de los 55 elementos hasta entonces conocidos, tomando como referencia el peso del Hidrogeno (1.0000), y publico la lista en 1828.
En 1829, el químico alemán Johann Wolfgang Dobereiner presento su estudio denominado "ley de las triadas"; según él, los elementos podían organizarse en grupos de tres elementos cada uno, y dentro de cada triada los elementos se colocaban en forma progresiva de sus pesos atómico. El observo mucha semejanza entre las propiedades químicas de los elementos de una triada, y lo mismo observo entre sus pesos atómicos, siendo el primero en relacionar ambos aspectos. Este trabajo lo confirmo el químico francés Jean Baptiste Dumas en 1851, año en el que se llegaron a conocer hasta veinte triadas, lo cual le dio cierta validez a esta ley.
En 1862, el químico francés Berguyer de Chancourtois presento su clasificación de los elementos, a los que organizo dentro de una espiral cilíndrica dividida en 16 secciones; en cada sección los elementos estaban situados en forma progresiva de sus pesos atómicos, con lo que presentaban propiedades físicas y químicas semejantes. Este trabajo no tuvo éxito.
Como puede observarse, los estudiosos de este periodo ya iban relacionando las propiedades de los elementos con sus respectivos pesos atómicos, que en realidad son masas atómicas.
El químico británico John Alexander Reina Newlands también relaciono el peso atómico con las propiedades de los elementos. Así, en 1864, expuso su trabajo denominado "ley de las octavas"; el ordeno los elementos en forma creciente de sus pesos atómicos y, de esta manera, observo que las propiedades del octavo elemento eran parecidas a las del primero, y las del noveno eran parecidas a las del segundo, y las propiedades del décimo elemento eran parecidas a las del tercer elemento, y así sucesivamente. En base a esto construyo grupos horizontales o hileras de siete elementos cada uno, y el octavo elemento siempre lo situó como primero de la sub-siguiente hilera.
Al formarlos en hileras, Newlands también dejo los elementos dispuestos en grupos verticales o columnas, convirtiéndose así en el primer trabajo que lo hizo de esta manera.
En realidad, Newlands observo que al colocar los pesos atómicos en forma creciente las propiedades de los elementos se comportaban en igual forma, pero esto no se cumplía para algunos elementos. A los colegas de Newlands no les parecía correcto esto, ni el hecho de que las hileras estuvieran formadas por tan solo siete elementos, por lo que esta ley fue rechazada y ridiculizada por sus colegas; sin embargo, su trabajo fue premiado por la Royal Society de Inglaterra, después de su fallecimiento.
Años más tarde, en 1869, dos científicos propusieron las primeras verdaderas tablas periódicas de que se tiene conocimiento: los químicos Dimitri Ivanovich Mendeleiev, de Rusia, y Julios Lothar Meyer, de Alemania. Ambos tomaron el peso atómico como base para la clasificación de los elementos en sus respectivas tablas, pero Dimitri relaciono este peso con las propiedades químicas y Lothar lo hizo con las físicas; ambos, en 1871, propusieron tablas periódicas reformadas. Hasta aquí se conocían 63 elementos químicos.
La tabla de Lothar Meyer no prospero debido a que era menos completa y complicada, en comparación con la de Mendeleiev.
Al momento de elaborar su segunda tabla, Mendeleiev tuvo presente que al relacionar el peso atómico con las propiedades se producía una periodicidad (repetición) de estas últimas, por lo que reviso y afino varios pesos atómicos, dejando, además, los espacios correctos en la tabla para los elementos por descubrir, lo cual se ha cumplido. Esto origino la "ley periódica de los elementos químicos" y, por esta y otras razones, su tabla se ha considerado como el prototipo de la moderna tabla periódica, aunque se equivocó al organizar a los elementos en base a su peso atómico.
En 1913, el físico ingles Henry Gwynn Jeffreys Moseley descubrió que la carga positiva del núcleo de los átomos (protones), al cual llamo número atómico, constituía una base más correcta para clasificar los elementos en la tabla periódica. De esta manera, la tabla de Mendeleiev fue corregida por este científico, originándose a la vez la moderna ley periódica de los elementos químicos: " las propiedades de los elementos químicos son una función periódica de su número atómico".
Esta tabla de Moseley constituye la actual tabla periódica de los elementos químicos.